pH và pKa là gì? Hiểu mối quan hệ giữa pH và pKa
Trong lĩnh vực hóa học và sinh học, pH và pKa là những khái niệm cơ bản nhưng vô cùng quan trọng, đóng vai trò nền tảng trong việc hiểu và giải thích nhiều hiện tượng xảy ra trong các phản ứng hóa học, sinh lý học cũng như quá trình xử lý công nghiệp.
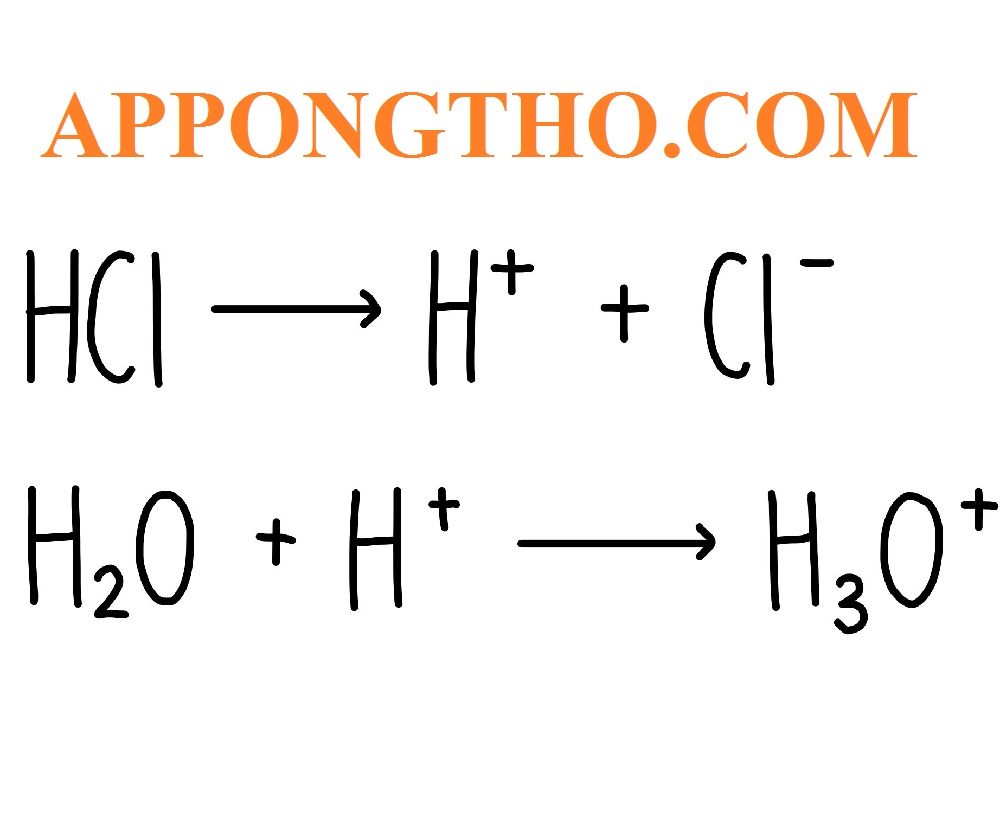
pH và pKa là gì? Hiểu mối quan hệ giữa pH và pKa
Bài viết này sẽ cung cấp một cái nhìn toàn diện về pH và pKa, cũng như giúp bạn hiểu rõ mối quan hệ giữa hai khái niệm này và tầm quan trọng của chúng.
Định nghĩa về pH
pH là một chỉ số đo lường mức độ axit hoặc bazơ của một dung dịch. Chỉ số này được tính dựa trên nồng độ của ion hydro (H⁺) trong dung dịch, và là một thang logarit âm, nghĩa là pH càng thấp thì nồng độ H⁺ càng cao. Công thức tính pH là:
pH=−log[H+]pH = -\log[H⁺]pH=−log[H+]
Trong đó:
- [H+][H⁺][H+] là nồng độ ion hydro (H⁺) trong dung dịch tính theo mol/lít (M).
Trên thang đo pH, các dung dịch có tính axit có giá trị pH nhỏ hơn 7, các dung dịch trung tính có pH bằng 7, và các dung dịch có tính bazơ có pH lớn hơn 7.
Ví dụ, nước tinh khiết có pH bằng 7, axit sulfuric có pH rất thấp (khoảng 0), còn dung dịch NaOH (natri hydroxide) có pH cao, khoảng 14.
Cách đo pH
Có nhiều phương pháp để đo pH, từ việc sử dụng giấy quỳ, máy đo pH đến các phương pháp điện cực kính hiện đại. Việc xác định chính xác pH rất quan trọng trong nhiều ứng dụng, đặc biệt là trong hóa học và sinh học, nơi mà sự biến đổi nhỏ về pH có thể ảnh hưởng lớn đến phản ứng hoặc quá trình sinh lý.
Nguyên Lý Mạng Điện Lắp Đặt Kiểu Nổi | Phân Loại & Thực Hành
Cách đo pH là quy trình xác định độ axit hoặc bazơ của một dung dịch, biểu thị bằng chỉ số pH. Chỉ số này đo lường nồng độ ion hydro (H⁺) có trong dung dịch, giúp ta biết được tính chất của dung dịch đó là axit hay bazơ.
Định nghĩa về pH
Các phương pháp phổ biến để đo pH như:
Sử dụng giấy quỳ (pH indicator paper):
Đây là phương pháp thủ công và đơn giản nhất. Giấy quỳ đổi màu khi nhúng vào dung dịch, và màu sắc của giấy được so sánh với bảng màu chuẩn để xác định pH.
- Ưu điểm: Dễ sử dụng, chi phí thấp, tiện lợi cho việc đo nhanh và ở nhiều điều kiện khác nhau.
- Nhược điểm: Độ chính xác không cao, không thể đo được pH một cách chính xác nếu cần số liệu cụ thể.
Sử dụng các chất chỉ thị màu (pH indicator):
Đây là các chất hóa học thay đổi màu sắc khi tiếp xúc với dung dịch có tính axit hoặc bazơ. Ví dụ, phenolphthalein hoặc methyl orange là các chất chỉ thị pH phổ biến.
Mỗi chất chỉ thị có một khoảng pH nhất định mà nó thay đổi màu, giúp đánh giá tính axit hoặc bazơ của dung dịch.
- Ưu điểm: Thích hợp cho các thí nghiệm hóa học nhanh.
- Nhược điểm: Không cung cấp được số liệu pH cụ thể, chỉ mang tính chất tương đối.
Sử dụng máy đo pH (pH meter):
Đây là phương pháp chính xác nhất để đo pH. Máy đo pH sử dụng một điện cực nhạy với ion H⁺ để đo nồng độ ion hydro trong dung dịch.
Phương pháp này cho kết quả cụ thể và có độ chính xác cao. Máy đo pH có thể đo được trong phạm vi pH từ 0 đến 14, với sai số rất nhỏ (thường chỉ khoảng 0,01 pH).
- Ưu điểm: Độ chính xác cao, phù hợp cho các ứng dụng cần số liệu cụ thể như trong phòng thí nghiệm, sản xuất công nghiệp, kiểm soát chất lượng nước.
- Nhược điểm: Chi phí cao hơn, yêu cầu hiệu chuẩn thường xuyên và cần người vận hành có kinh nghiệm.
Sử dụng điện cực kính (glass electrode):
Đây là một loại điện cực sử dụng trong máy đo pH, hoạt động dựa trên việc đo sự chênh lệch điện thế giữa điện cực nhạy cảm với ion H⁺ và một điện cực tham chiếu.
Tụ Điện Là Gì? Cấu tạo & Công Thức Tính Điện Áp Hiệu Dụng
Điện cực kính có khả năng đo pH rất chính xác và thường được sử dụng trong các thí nghiệm hóa học và các ứng dụng công nghiệp.
Lưu ý khi đo pH:
Hiệu chuẩn máy đo pH:
- Máy đo pH cần được hiệu chuẩn bằng cách sử dụng các dung dịch đệm (pH chuẩn) để đảm bảo độ chính xác trong quá trình đo.
Nhiệt độ ảnh hưởng đến pH:
- Nhiệt độ của dung dịch có thể ảnh hưởng đến kết quả đo pH, do đó nên sử dụng máy đo pH có khả năng bù nhiệt độ hoặc đo trong điều kiện nhiệt độ ổn định.
Các phương pháp đo pH có vai trò quan trọng trong nhiều ngành nghề như hóa học, sinh học, y học, nông nghiệp và sản xuất công nghiệp, giúp đảm bảo độ an toàn và chất lượng sản phẩm.
Ứng dụng của pH
Trong ngành công nghiệp:
- pH được sử dụng để kiểm soát quá trình xử lý nước, sản xuất hóa chất, chế biến thực phẩm và đồ uống.
Trong y học:
- pH của cơ thể (đặc biệt là pH máu) được duy trì trong khoảng hẹp từ 7,35 đến 7,45 để đảm bảo các chức năng sinh lý quan trọng diễn ra ổn định.
Trong nông nghiệp:
- Đất có pH thích hợp giúp cây trồng phát triển tốt hơn.
Định nghĩa về pKa
pKa là hằng số phân ly axit (Ka) được biểu thị dưới dạng logarithm âm. Nó cho biết mức độ dễ dàng một axit có thể nhả proton (H⁺) vào dung dịch. pKa càng nhỏ, axit càng mạnh, nghĩa là axit càng dễ dàng phân ly và nhả H⁺. Công thức của pKa là:
pKa=−log(Ka)pKa = -\log(Ka)pKa=−log(Ka)
Trong đó:
- KaKaKa là hằng số phân ly axit, đại diện cho tỷ lệ phân ly của axit trong dung dịch.
pKa thường được sử dụng để so sánh độ mạnh của các axit. Ví dụ, axit clohydric (HCl) có pKa rất nhỏ (gần bằng 0), cho thấy nó là một axit rất mạnh, trong khi axit acetic có pKa khoảng 4,75, cho thấy nó là một axit yếu.

Định nghĩa về pKa
Cách tính pKa
pKa được tính từ hằng số phân ly Ka của axit dựa trên công thức:
Ka=[A−][H+][HA]Ka = \frac{[\text{A}^-][H^+]}{[\text{HA}]}Ka=[HA][A−][H+]
Trong đó:
- [A−][\text{A}^-][A−] là nồng độ của bazơ liên hợp.
- [HA][\text{HA}][HA] là nồng độ của axit chưa phân ly.
Ứng dụng của pKa
Trong hóa học dược phẩm:
- pKa giúp xác định liệu một loại thuốc có ở dạng ion hay không ion trong cơ thể.
- Điều này rất quan trọng vì dạng không ion dễ dàng thẩm thấu qua màng tế bào hơn, ảnh hưởng đến khả năng hấp thu của thuốc.
Trong phân tích hóa học:
- pKa được sử dụng để tính toán và thiết kế các hệ đệm, giúp duy trì độ pH ổn định trong dung dịch.
Mối quan hệ giữa pH và pKa
Mối quan hệ giữa pH và pKa được diễn tả qua phương trình Henderson-Hasselbalch:
pH=pKa+log([A−][HA])pH = pKa + \log \left( \frac{[\text{A}^-]}{[\text{HA}]} \right)pH=pKa+log([HA][A−])
Phương trình này mô tả sự cân bằng giữa axit (HA) và bazơ liên hợp của nó (A⁻) trong một dung dịch. Nó cho phép ta tính toán pH của dung dịch dựa trên pKa và tỉ lệ nồng độ giữa axit và bazơ liên hợp.

Mối quan hệ giữa pH và pKa
Mối quan hệ giữa pH và pKa là một khái niệm quan trọng trong hóa học, đặc biệt trong lĩnh vực axit-bazơ và dung dịch đệm. Sự tương quan này được miêu tả thông qua phương trình Henderson-Hasselbalch, một phương trình cơ bản giúp xác định độ cân bằng giữa axit và bazơ liên hợp trong dung dịch.
Phương trình Henderson-Hasselbalch:
Mối quan hệ giữa pH và pKa được biểu thị qua phương trình Henderson-Hasselbalch:
pH=pKa+log([A−][HA])pH = pKa + \log \left( \frac{[A^-]}{[HA]} \right)pH=pKa+log([HA][A−])
Trong đó:
- [A−][A^-][A−]: Nồng độ của bazơ liên hợp (dạng ion hóa).
- [HA][HA][HA]: Nồng độ của axit không phân ly (dạng chưa ion hóa).
Ý nghĩa của mối quan hệ giữa pH và pKa:
Khi pH = pKa:
- Ở điểm này, nồng độ của axit ([HA][HA][HA]) và bazơ liên hợp ([A−][A^-][A−]) bằng nhau.
- Đây là điểm mà một axit yếu sẽ bị ion hóa 50%, và một nửa axit sẽ tồn tại dưới dạng bazơ liên hợp.
Khi pH < pKa:
- Dung dịch có tính axit hơn (nhiều H⁺ hơn), và axit ([HA][HA][HA]) sẽ chiếm ưu thế, có nghĩa là axit ít bị phân ly và tồn tại nhiều ở dạng không ion hóa.
Khi pH > pKa:
- Dung dịch có tính bazơ hơn (ít H⁺ hơn), và bazơ liên hợp ([A−][A^-][A−]) sẽ chiếm ưu thế, tức là axit đã bị phân ly nhiều và tồn tại chủ yếu dưới dạng ion hóa.
Tầm quan trọng của mối quan hệ giữa pH và pKa:
Biết được pKa và pH của dung dịch, chúng ta có thể dự đoán được dạng chủ yếu mà một chất sẽ tồn tại trong dung dịch – dưới dạng axit hay bazơ.
Hiểu rõ mối quan hệ này giúp ta dễ dàng điều chỉnh pH của dung dịch sao cho phù hợp với mục đích sử dụng, như trong các quy trình hóa học, sinh học hoặc sản xuất công nghiệp.
Mối quan hệ này cực kỳ quan trọng trong việc giải thích hoạt động của các hệ đệm trong cơ thể, giúp duy trì sự ổn định pH trong môi trường sinh học.
Mối quan hệ giữa pH và pKa giúp dược sĩ hiểu rõ hơn về khả năng hấp thu và phân phối thuốc trong cơ thể, từ đó tối ưu hóa hiệu quả điều trị.
Điện Tử Công Suất là gì? Mô Phỏng Điện Tử Công Suất
Như vậy, mối quan hệ giữa pH và pKa giúp chúng ta hiểu và kiểm soát các phản ứng hóa học trong dung dịch, từ đó có thể điều chỉnh, tối ưu hóa các quá trình và sản phẩm trong thực tế.
Phương trình Henderson-Hasselbalch:
Phương trình Henderson-Hasselbalch là một công thức trong hóa học, dùng để xác định mối quan hệ giữa độ pH của một dung dịch và tỷ lệ giữa nồng độ của dạng axit không phân ly và dạng bazơ liên hợp.
Phương trình này chủ yếu được sử dụng để tính toán pH của các dung dịch đệm – những dung dịch có khả năng duy trì pH ổn định khi thêm một lượng nhỏ axit hoặc bazơ.
Khi pH = pKa:
- Nồng độ của axit và bazơ liên hợp bằng nhau.
- Điều này có nghĩa rằng dung dịch tồn tại ở trạng thái cân bằng, với một nửa axit bị phân ly thành bazơ liên hợp.
Khi pH < pKa:
- Dạng axit (HA) chiếm ưu thế vì môi trường có tính axit hơn, khiến axit ít phân ly.
Khi pH > pKa:
- Dạng bazơ liên hợp (A⁻) chiếm ưu thế vì môi trường có tính bazơ hơn, khuyến khích axit phân ly.
Ứng dụng của mối quan hệ giữa pH và pKa
Mối quan hệ giữa pH và pKa không chỉ là khái niệm lý thuyết trong hóa học mà còn có nhiều ứng dụng thực tế trong các lĩnh vực sinh học, dược học, hóa học và công nghiệp.
Hiểu được sự tương quan này giúp chúng ta tối ưu hóa các quy trình liên quan đến axit-bazơ, từ đó cải thiện hiệu suất và chất lượng trong nhiều hệ thống khác nhau.
Dự đoán trạng thái của chất trong dung dịch:
- Hiểu rõ pKa của một chất giúp dự đoán trạng thái của nó (axit hoặc bazơ liên hợp) ở một giá trị pH cụ thể.
- Điều này rất quan trọng trong việc nghiên cứu về dược phẩm và sinh học, khi ta cần biết liệu một chất có dễ dàng hòa tan hay hấp thụ vào cơ thể hay không.
Điều chỉnh pH của dung dịch:
- Mối quan hệ này được ứng dụng để điều chỉnh pH dung dịch sao cho tối ưu hóa sự phân ly của các chất, từ đó ảnh hưởng đến độ hòa tan, khả năng phản ứng và hoạt tính sinh học của chúng.
Hiểu về quá trình sinh học:
- Trong sinh học, nhiều quá trình quan trọng như hô hấp tế bào, chức năng enzyme, và hệ đệm trong cơ thể phụ thuộc vào mối quan hệ giữa pH và pKa.
- Ví dụ, các enzym có hoạt tính tối ưu ở một giá trị pH nhất định, và sự thay đổi pH có thể làm suy giảm hoạt tính của enzyme bằng cách thay đổi trạng thái ion hóa của nó.
Thiết kế hệ đệm:
- Hệ đệm là một hệ thống chứa cả axit yếu và bazơ liên hợp của nó, giúp duy trì pH ổn định trong một phạm vi nhất định.
- Hiểu được pKa của các thành phần trong hệ đệm giúp điều chỉnh pH dung dịch một cách hiệu quả.
Ví dụ như trong các phản ứng sinh hóa, hoặc trong ngành dược phẩm khi cần đảm bảo sự ổn định của các hợp chất.
Ví dụ minh họa mối quan hệ giữa pH và pKa
Mối quan hệ giữa pH và pKa có thể được minh họa rõ ràng qua các ví dụ thực tế, đặc biệt trong lĩnh vực sinh học và dược học, nơi sự ion hóa của các phân tử phụ thuộc vào pH của môi trường và giá trị pKa của chúng.
1: Aspirin
Aspirin là một axit yếu có pKa khoảng 3,5. Khi đưa vào dạ dày với pH khoảng 1,5, aspirin chủ yếu tồn tại ở dạng không ion (HA), giúp nó dễ dàng thẩm thấu qua màng dạ dày vào máu.
Tuy nhiên, khi aspirin đi vào ruột non với pH khoảng 7,5, nó chuyển sang dạng ion hóa (A⁻), khiến khả năng hấp thụ của nó giảm đi.
Điều này giúp giải thích vì sao aspirin có hiệu quả cao khi uống qua đường dạ dày.
2: Hệ đệm bicarbonate trong máu
Hệ đệm bicarbonate trong cơ thể người bao gồm axit carbonic (H₂CO₃) và ion bicarbonate (HCO₃⁻). pKa của axit carbonic là 6,1.
Máu người có pH bình thường khoảng 7,4, tức là môi trường bazơ hơn pKa của axit carbonic, khiến ion bicarbonate (HCO₃⁻) chiếm ưu thế.
Khi cơ thể gặp tình trạng nhiễm toan (pH giảm), hệ đệm này sẽ trung hòa axit dư thừa bằng cách hấp thụ H⁺, giúp duy trì pH máu ổn định.
3: Hệ đệm phosphat
Hệ đệm phosphat được ứng dụng nhiều trong phòng thí nghiệm để điều chỉnh pH của dung dịch.
Hệ này bao gồm ion dihydrophosphate (H₂PO₄⁻) và ion monohydrophosphate (HPO₄²⁻), với pKa là 7,2.
Đây là hệ đệm rất hiệu quả để giữ pH trong khoảng trung tính.
Hiểu rõ pH và pKa là điều cơ bản trong việc nắm vững các khái niệm liên quan đến axit-bazơ trong hóa học và sinh học.
Mối quan hệ giữa pH và pKa qua phương trình Henderson-Hasselbalch cho phép chúng ta dự đoán được trạng thái của các chất trong dung dịch, điều chỉnh pH và thiết kế các hệ đệm hiệu quả.
10 Câu hỏi thường gặp về pH và pKa ( FAQ )
10 Câu hỏi thường gặp về pH và pKa ( FAQ )
Trong hóa học, pH và pKa là hai khái niệm quan trọng, đặc biệt trong việc hiểu tính axit và bazơ của các dung dịch. Bài viết này sẽ giải đáp các câu hỏi liên quan đến pH, pKa và các ứng dụng của chúng trong thực tế.
1. pH của máu người là bao nhiêu?
- pH của máu người thường nằm trong khoảng từ 7,35 đến 7,45.
- Mức pH này mang tính kiềm nhẹ, giúp duy trì các hoạt động sinh lý bình thường của cơ thể.
- Nếu pH máu giảm xuống dưới 7,35, có thể dẫn đến tình trạng toan hóa máu, gây hại cho sức khỏe.
- Ngược lại, nếu pH máu tăng lên trên 7,45, tình trạng kiềm hóa máu có thể xảy ra, gây ra những rủi ro nghiêm trọng.
- Các hệ đệm bicarbonate trong cơ thể và chức năng của thận đóng vai trò quan trọng trong việc duy trì pH ổn định.
- Sự thay đổi nhỏ trong pH máu có thể ảnh hưởng đến hoạt động của enzyme và quá trình trao đổi chất.
2. Chất chỉ thị phổ biến để đo pH là gì?
- Quỳ tím là chất chỉ thị phổ biến nhất để đo pH nhanh chóng, đổi màu từ đỏ sang xanh.
- Phenolphthalein: Sử dụng để đo pH trong môi trường kiềm, chuyển từ không màu sang hồng khi pH > 8.2.
- Methyl cam: Đo pH trong môi trường axit, màu sắc thay đổi từ đỏ sang vàng khi pH tăng.
- Bromothymol blue: Thường dùng trong khoảng pH từ 6.0 đến 7.6, màu sắc chuyển từ vàng (axit) sang xanh (kiềm).
- Giấy chỉ thị pH: Một phương pháp nhanh chóng để đo pH, với nhiều sắc màu phản ánh nồng độ axit hoặc kiềm.
- Đồng hồ đo pH (pH meter): Thiết bị điện tử cho phép đo chính xác pH bằng cách sử dụng điện thế sinh ra từ ion H⁺.
3. Mưa acid có liên quan gì đến pH?
- Mưa acid là nước mưa có pH thấp, thường dưới 5,6, gây ảnh hưởng nghiêm trọng đến môi trường.
- Sự hình thành mưa acid chủ yếu do khí SO₂ và NOₓ phản ứng với nước trong khí quyển tạo thành axit sulfuric và axit nitric.
- Khi pH của nước mưa giảm, mưa acid có thể gây hại cho cây cối, các công trình kiến trúc và sinh vật nước.
- Mưa acid ảnh hưởng đến độ pH của đất, làm giảm tính chất dinh dưỡng và ảnh hưởng đến sự phát triển của cây trồng.
- Các hồ và sông bị mưa acid có thể trở nên quá chua, gây nguy hiểm cho các sinh vật sống trong đó.
- Giảm lượng khí thải SO₂ và NOₓ từ công nghiệp và giao thông là biện pháp chính để hạn chế mưa acid.
4. Đất chua có pH như thế nào?
- Đất chua có pH dưới 7, thường nằm trong khoảng 4,5 đến 6,5.
- Độ chua của đất thường do sự hiện diện của ion H⁺ và Al³⁺ trong đất.
- Đất chua thường nghèo dinh dưỡng, ảnh hưởng xấu đến sự phát triển của cây trồng.
- Cây trồng nhạy cảm với pH đất sẽ gặp khó khăn trong việc phát triển trong môi trường này.
- Việc xác định độ pH của đất là rất quan trọng để biết được các biện pháp cải thiện cần thiết.
- Các loại cây thích hợp với đất chua thường có khả năng chịu đựng các điều kiện khắc nghiệt hơn.
5. Làm sao để tăng pH của đất?
- Sử dụng vôi (CaCO₃ hoặc CaO) là phương pháp phổ biến nhất để tăng pH của đất.
- Bón thạch cao (CaSO₄) cũng có thể giúp làm giảm độ chua và cải thiện cấu trúc đất.
- Bón tro gỗ: Tro gỗ có tính kiềm, có thể thêm vào đất để nâng cao pH.
- Sử dụng canxi nitrat hoặc magie oxit cũng là cách khác để làm tăng pH đất.
- Đảm bảo tưới nước đầy đủ sau khi bón các chất kiềm để phân bón được hòa tan và thấm vào đất.
- Kiểm tra pH đất định kỳ để điều chỉnh lượng phân bón hợp lý nhằm tránh tình trạng kiềm hóa quá mức.
6. pKa là gì?
- pKa là hằng số axit mô tả mức độ mạnh yếu của một axit.
- Nó là logarit âm của hằng số phân ly axit (Ka), với công thức: pKa = -log(Ka).
- pKa cho biết khả năng nhả proton (H⁺) của một chất trong dung dịch.
- Axit có pKa càng nhỏ, thì càng mạnh và càng dễ mất proton.
- Ngược lại, pKa lớn chỉ ra một axit yếu hơn, khó nhả proton.
- pKa giúp xác định mức độ ion hóa của một chất ở một giá trị pH cụ thể.
7. pKa ảnh hưởng đến tính axit/bazơ của chất như thế nào?
- pKa là thước đo để xác định độ mạnh của một axit.
- Khi pH của dung dịch gần bằng pKa, cả hai dạng ion hóa và không ion hóa đều tồn tại với tỉ lệ đáng kể.
- pKa thấp hơn pH cho thấy axit đang ở dạng không ion hóa nhiều hơn.
- pKa cao hơn pH cho thấy dạng bazơ liên hợp chiếm ưu thế.
- Biết được pKa của một chất giúp dự đoán tính chất axit/bazơ của nó trong các điều kiện khác nhau.
- Ứng dụng của pKa trong các lĩnh vực như dược học và sinh học rất quan trọng trong việc phát triển thuốc và hiểu quá trình sinh hóa.
8. Chất có pKa càng nhỏ thì tính axit càng…?
- Chất có pKa càng nhỏ thì tính axit càng mạnh.
- Các axit mạnh có khả năng nhả proton dễ dàng hơn, dẫn đến pKa thấp hơn.
- Ví dụ, axit sulfuric (pKa ≈ -3) rất mạnh, trong khi axit acetic (pKa ≈ 4.76) là axit yếu hơn.
- pKa giúp phân loại các axit từ mạnh đến yếu dựa trên khả năng nhả proton.
- Hiểu được mối quan hệ giữa pKa và pH là chìa khóa trong nhiều lĩnh vực nghiên cứu.
- Thông qua việc biết pKa, ta có thể dự đoán cách mà các chất sẽ tương tác trong môi trường sinh hóa.
9. Làm sao để xác định pKa của một axit yếu?
- Một phương pháp phổ biến là sử dụng phương pháp chuẩn độ để xác định điểm tương đương.
- Biểu đồ pH có thể được vẽ trong quá trình chuẩn độ để xác định pKa tại điểm giữa của đường cong.
- Có thể sử dụng phương pháp quang phổ để xác định nồng độ axit ở các pH khác nhau.
- Thí nghiệm thực nghiệm để đo pH tại các nồng độ axit khác nhau và xây dựng đồ thị log([A-]/[HA]) có thể giúp tìm pKa.
- Sử dụng phương trình Henderson-Hasselbalch có thể tính toán pKa từ các giá trị pH.
- Tham khảo tài liệu khoa học về các axit đã biết để có các giá trị pKa để so sánh.
10. pH của dung dịch đệm phụ thuộc vào yếu tố nào?
- pH của dung dịch đệm phụ thuộc vào tỉ lệ nồng độ giữa axit và bazơ liên hợp.
- Nồng độ của axit (HA) và bazơ (A⁻) trong dung dịch quyết định pH của hệ thống.
- pKa của axit liên quan đến dung dịch cũng ảnh hưởng đến pH, cho biết khả năng nhả proton.
- Nhiệt độ có thể ảnh hưởng đến pKa và do đó làm thay đổi pH của dung dịch đệm.
- Khả năng của dung dịch đệm để duy trì pH ổn định phụ thuộc vào khả năng chịu đựng với sự thay đổi nồng độ axit/bazơ.
- Việc bổ sung các chất khác vào dung dịch đệm cũng có thể làm thay đổi pH, ảnh hưởng đến độ ổn định của hệ thống.
Như vậy, pH và pKa không chỉ là những khái niệm lý thuyết mà còn có nhiều ứng dụng trong thực tế, từ việc duy trì sức khỏe cho con người đến cải thiện chất lượng đất và phát
Việc hiểu và ứng dụng đúng cách những khái niệm này không chỉ giúp ta giải thích được nhiều hiện tượng khoa học mà còn hỗ trợ trong việc phát triển các ứng dụng thực tiễn như dược phẩm, y học và công nghiệp.




